Un élément chimique peut se trouver sous plusieurs formes : atome, ion, ou dans une molécule, combiné avec d’autres éléments.
L’élément sodium Na est ce qui est commun à l’atome de sodium, l’ion sodium Na+, et le chlorure de sodium NaCl.
Des éléments comme ceux du tableau suivant, il en existe environ une centaine. Les plus courants sont indiqués dans ce tableau :
|
H hydrogène |
|
|
|
|
|
|
He hélium |
|
Li lithium |
Be Béryllium |
B Bore |
C Carbone |
N azote |
O oxygène |
F fluor |
Ne néon |
|
Na sodium |
Mg magnésium |
Al aluminium |
Si silicium |
P phosphore |
S soufre |
Cl chlore |
Ar Argon |
|
K potassium |
Ca calcium |
|
|
|
|
Br brome |
Kr Krypton |
# Atomes et ions
La matière est neutre, mais peut être constituée de particules de charges électriques opposées + et -
Ainsi : l'atome (qui est lui-même neutre) contient autant de protons dans son noyau, que d'électrons dans son cortège électronique.
Mais à une échelle plus grande que l'échelle atomique, un ensemble d'atomes est un ensemble neutre.
Des électrons peuvent quitter ou venir sur un atome : il se forme alors un ion monoatomique (constitué d’un seul atome).
Ce sont des atomes ayant perdu (cation, positif) ou gagné (anion, négatif) un ou plus électrons.
Exemple de cations : l’ion hydrogène H+, l’ion sodium Na+, l’ion potassium K+, l’ion calcium Ca2+, l’ion magnésium Mg2+
Exemple d’anions : l’ion chlorure Cl-, l’ion fluorure F-
Dans la matière, les anions et les cations se présentent ensembles, de sorte que leurs charges électriques se compensent. Encore une fois, il s'agit d'un problème d'échelle : un composé ionique est globalement neutre, mais si on l'observe dans le détail, il est constitué d'ions de charges opposés.
quelques ions polyatomiques présents dans les boissons
Dans les boissons, les ions polyatomiques principaux sont :
L’ion sulfate SO42-, l’ion carbonate CO32-, l’ion hydrogénocarbonate HCO3-, l’ion nitrate NO3-
Ce sont des édifice hybrides, possédant plusieurs atomes reliés par des liaisons covalentes, ainsi qu’une charge électrique positive ou négative répartie sur l’ensemble de l’édifice.
Par exemple : l’ion carbonate CO32-, contient 1 atome de carbone, 3 atomes d’oxygène, et une charge électrique négative -1 répartie sur l’ensemble de ces 4 atomes.
# Composés ioniques ## Liaison ionique
Dans un composé ionique, les ions sont liés par des forces ioniques très fortes que l’on appelle : liaison ionique.
Il s’agit d’une force d’attraction électrique due à la nature (+) et (-) de chaque ion.
L'apport de chaque type d'ions permet la neutralité électrique :
par exemple, dans NaCl, il y a autant de Na+ que de Cl-
autres exemples :
le carbonate de calcium CaCO3(s) : il est constitué des ions Calcium Ca2+ et carbonate CO32- dont les charges électrique se neutralisent une fois l’édifice formé.
Le chlorure de calcium CaCl2 : il est constitué d’un ion calcium Ca2+ et de 2 ions Cl-, de sorte que les charges électriques se neutralisent. Il y a alors autant de charges (+), apportées par Ca2+ que de charges (-), apportées par 2 ions Cl-.
## Formation ou dissolution d'un composé ionique
Lorsqu’il se forme un composé ionique à partir d’ion, on peut traduire ceci par la réaction chimique :
(exemple de la formation de chlorure de sodium)
Na+(aq) + Cl-(aq) => NaCl(s)
Et lorsqu'il se dissout et se dissocie : NaCl(s) => Na+(aq) + Cl-(aq)
# famille d'éléments chimiquesles éléments ont des propriétés chimiques voisines et sont rassemblés en famille.
## les alcalins : Li, Na et KIls occupent la 1ere colonne du tableau périodique des éléments.
Ils se trouvent le plus souvent sous la forme d’un ion portant une charge +1.
Ils s'associent souvent avec halogènes.
## les alcalino-terreux : Be, Mg et CaIls occupent la 2e colonne du tableau périodique des éléments.
Ils se trouvent le plus souvent sous la forme d’un ion portant une charge +2.
Leurs ions précipitent avec l’ion hydroxyde OH-.
Ils s'associent souvent avec l’ion carbonate CO32- , comme par exemple dans le carbonate de calcium Ca CO3. Ils sont responsables de la dureté de l'eau.
## Les halogènes : F, Cl, Br, I (l’iode)Ils occupent l'avant dernière colonne du tableau périodique des éléments.
Ils se trouvent le plus souvent sous la forme d’un ion portant une charge -1. Leurs ions précipitent avec l’ion Ag+ pour former un composé ionique qui noircit à la lumière.
Ils s’associent souvent les alcalins.
## Les gaz rares :He, Ne, Ar, KrIls occupent la dernière colonne du tableau périodique des éléments.
Ils présentent une inertie chimique telle qu’il ne réagissent avec aucune espèce chimique et sont très difficilement ionisables.
## Les autres éléments chimiques
Les autres éléments (colonnes de B, C, N, O)ont plutôt des propriétés covalentes (ils forment facilement des molécules et s’associent avec d’autres atomes).
# tableau périodique des éléments
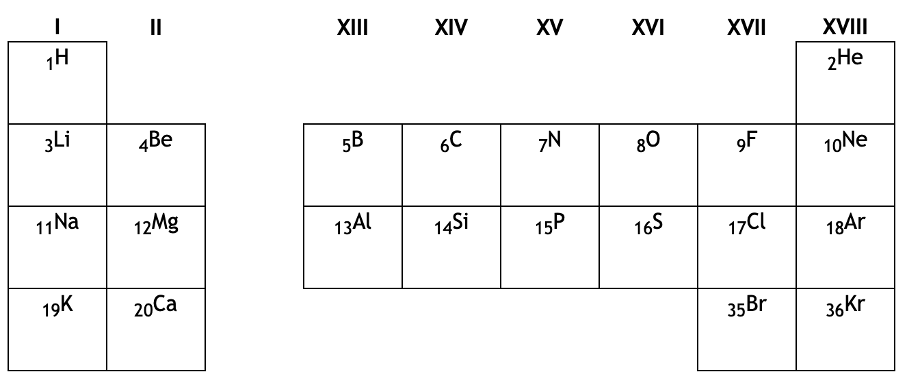
La tableau des éléments classe ceux-ci par numéro atomique croissant. On rappelle qu'à chaque élément correspond un SEUL numéro atomique, et donc, que le numéro atomique permet de deviner l'élément (exemple : Z = 6 : c'est le carbone..!)
Chaque case du tableau renseigne sur le numéro atomique, le nom, le symbole, et la masse molaire atomique de l’élément.
On peut déduire de ce tableau des propriétés particulières, comme :
- l’appartenance à une même famille chimique d’éléments (une même colonne)
- le numéro de la couche électronique externe (égal au numéro de la ligne)
- l’électronégativité de ces éléments (d’autant plus élevée que l’élément est en haut, à droite dans le tableau).
