modele de couches electroniques
Les électrons respectent un positionnement par couches. Pour les éléments Z = 1 à 20 (hydrogène jusqu’au calcium) les couches électroniques sont au nombre de 4 et sont représentées par des numéros : n=1, n=2, n=3…
En partant du centre de l’atome, nous croisons successivement les couches : n=1, n=2, n=3…
Les électrons commencent d’abord par remplir les couches intérieures de l’atome. C’est-à-dire que la couche n=2 ne se remplira que lorsque la couche n=1 sera complètement remplie (n = 1 contient 2 electrons).
De même, la couche n=3 ne commencera à se remplir que lorsque les couches n=2 sera complète (avec 8 électrons), et ainsi de suite.
Le nombre d’électrons par couche électronique d’un atome est ensuite : 8 pour la couche n=3, et encore plus pour la n=4.
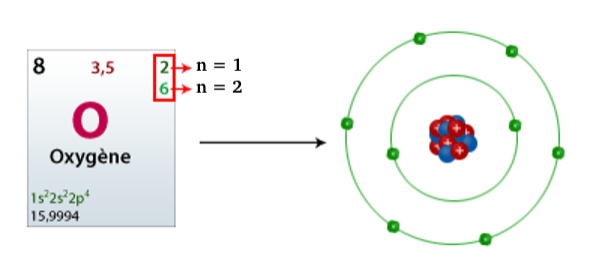
Exemple : l’atome d’oxygène : Z = 8 : Structure électronique où 2 électrons occupent la couche n=1, et 6 électrons celle n=2.
Les électrons de l’atome d’oxygène sont donc répartis sur les deux couches 1 et 2. La couche n=1, la plus proche du noyau est complète avec 2 électrons et la couche n=2, en partie remplie avec 6 électrons.
Remplissage des couches électroniques et tableau périodique
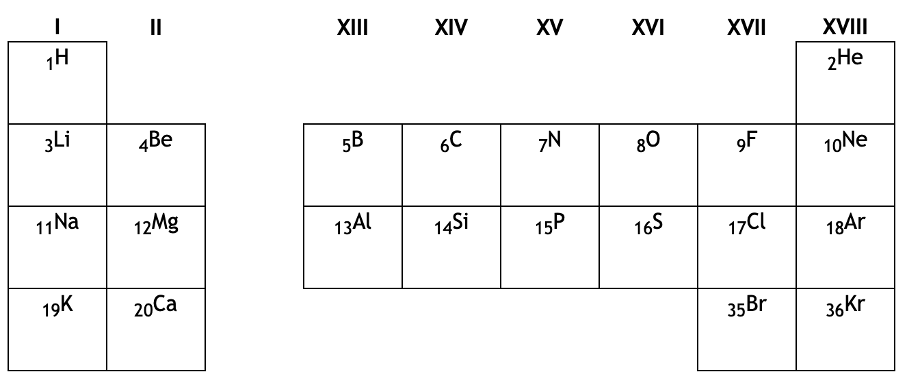
Dans le tableau périodique, les lignes (que l’on appelle PERIODE) sont justement repérées par n=1 (1ere periode), n=2 (2e periode)…
- Pour les élements placés dans la ligne n=1, seule la couche électronique n=1 est partiellement remplie.
- Pour les élements placés dans la ligne n=2, la couche n=1 est complètement remplie, et la couche électronique n=2 est partiellement remplie. Le nombre d’électrons qui remplissent la couche n=2 est justement le n° de la colonne (du tableau réduit).
Exemple : Pour l’atome de carbone, Z = 6. Celui-ci occupe la 2e ligne et la 4e colonne. Donc sa couche n=1 est remplie avec 2 electrons, et sa couche n=2 est partiellement remplie avec 4 electrons.
On écrira que la structure elctronique du C est:
- n=1 : 2 electrons
- n=2 : 4 electrons
- On adapte ensuite cette regle aux élements de la periode n=3.
Et pour les atomes K et Ca de la 4e ligne, la couche de valence est la couche n=4.
Les électrons de la couche de valence sont importants, car ce sont ceux-ci qui joueront un rôle dans les liaisons que formera l’atome puisque ce sont les moins attachés au noyau, les plus libres.
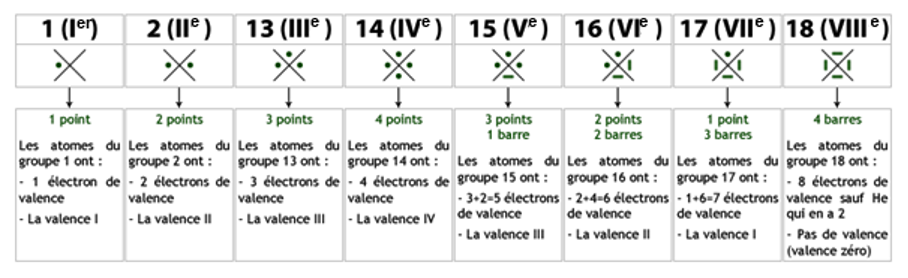
Electrons de valence
La couche la plus éloignée du noyau, celle qui est en principe partiellement remplie (*), est appelée : couche externe, ou couche de valence.
(*) Cette couche est toujours remplie pour les gaz rares.
La couche de valence contient les électrons de valence. Par exemple, dans le cas de l’oxygène, la couche de valence est la couche n=2 qui contient les 6 électrons de valence.
tableau reduit des elements
Exemple :
en reprenant l’exemple du C. Celui ci a pour couche de valence n=2. Il occupe donc la 2e periode du tableau périodique.
Son nombre d’electrons de valence est egal à 4 : Il occupe donc la 44 colonne du tableau périodique reduit. (ou 14e dans le tableau complet).
Schéma de Lewis
Principe
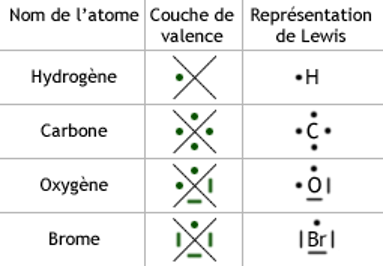
la représentation de Lewis. Celle-ci représente les seuls electrons de valence d’un atome à l’aide de points ou de barres, distribués autour de l’atome:
schema de Lewis des atomes
- Selon le nombre d’électrons de valence, les atomes ont un schéma de Lewis particulier.
- Les atomes d’une même colonne ont le même schéma de Lewis.
Valence d’un atome = nombre d’électrons LIANTS
Regle : Un point représente un électron liant (qui peut former une liaison), et une barre représente un doublet électronique, c’est-à-dire deux électrons non liants.
Reprenons l’atome d’oxygène comme exemple. Il possède 6 électrons dans sa couche de valence:
- 2 électrons marqués avec un point: donc susceptibles de former des des liaisons chimiques.
- et 2 barres : 2 doublets non liants.
Définition : Le nombre de points dans le schéma de Lewis est aussi appelé : la valence d’un atome. C’est aussi le nombre de liaisons que peut faire un atome. Pour l’oxygène, la valence est égale à 2. Pour le carbone, elle est égale à 4.
schéma de Lewis et regle de l’octet
Regle de l’octet : Les entités issues d’un élément chimique sont stables si leur couche de valence est complètement remplie: 2 electrons pour les atomes de numero atomique Z=1 à Z=5, et 8 electrons pour les autres.
Ainsi, les atomes de la colonne des gaz rares ont tous leur couche de valence remplie:
He: Z=2. structure electronique: n=1 : 2 electrons
Ne: Z=10. structure electronique: n=1 : 2 electrons, n=2 : 8 electrons
Les autres atomes vont former des ions, en gagnant ou en perdant des electrons, pour avoir la structure electronique du gaz rare le plus proche:
Li : Z=3. Va perdre 1 electron pour avoir la configuration electronique de He: n=1 : 2 electrons
F: Z=9. Va gagner 1 electron pour avoir la configuration electronique de Ne: n=1 : 2 electrons, n=2 : 8 electrons
schéma de Lewis de molécules simples
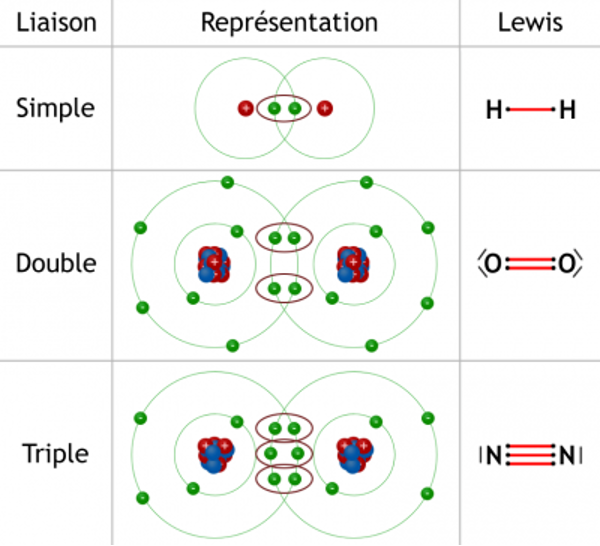
Liaison covalente
Une liaison covalente résulte de la mise en commun de 2 électrons de valence par deux atomes. Ces 2 électrons sont localisés entre les 2 atomes, et sont matérialisés par un trait entre les 2 atomes lorsque l’on dessine la molécule. C’est une liaison chimique.
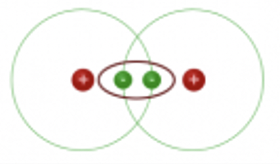
dihydrogène H
- On représente les schémas de Lewis des atomes, en dirigeant les électrons marqués par un point, vers l’autre atome. (étape 1)
- On trace un trait entre 2 électrons de valence portés par 2 atomes. (2)
- On efface ensuite les points qui ont aidé au tracé, mais ne présentent plus d’intérêt: On sait maintenant que le trait droit est constitué d’un doublet d’électrons. (3)
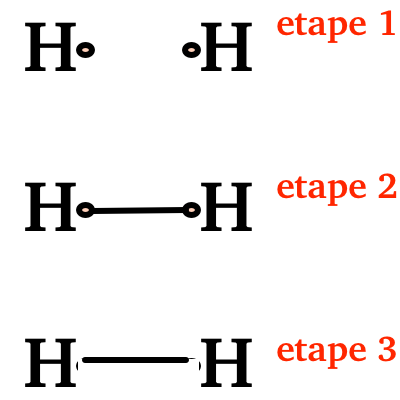
construction du schéma de Lewis H2
- 2 electrons de valence si leur numero atomique est inferieur ou egal à 5
- 8 electrons de valence sinon.
Exemples :
- Dihydrogène H2 : il manque 1 electron à chaque hydrogène pour être entourés de 2 electrons de valence.
En partageant leur électron, il se forme une liaison covalente entre chaque H. Ce qui permet à chaque hydrogène d’être entouré de 2 électrons.
- Méthane CH4 : il manque 1 electron à chaque hydrogène et 4 électrons au carbone pour être entouré de 8 electrons de valence. Le carbone va alors faire 4 liaisons simples avec les atomes H.
- Le carbone sera entouré de 8 électrons de valence.
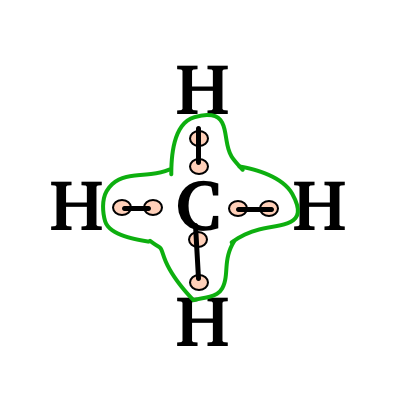
C est entouré de 8 electrons de valence
- Et chaque H de 2 électrons de valence.
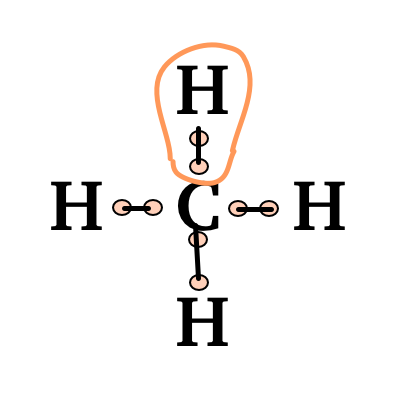
H est entouré de 2 electrons de valence
liaisons doubles, triples
liaisons multiples
On trouve une liaison triple dans le diazote par exemple.
Liaison polarisée
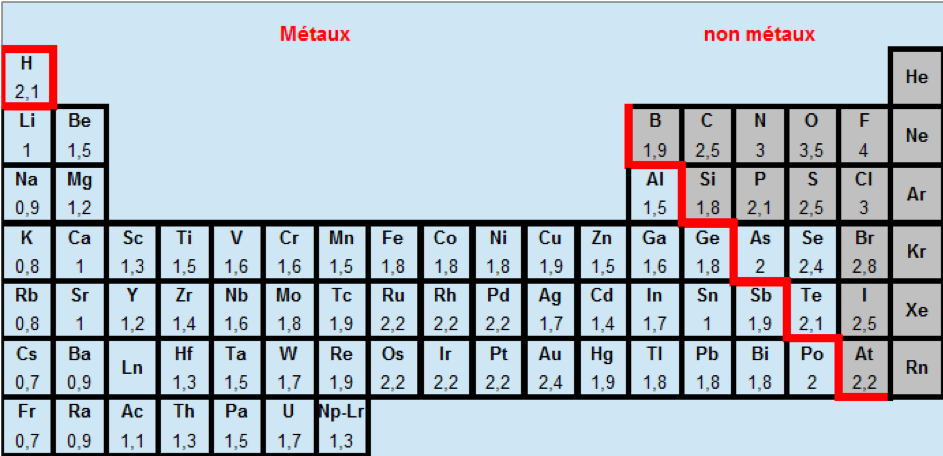
On dit qu’une liaison covalente est polarisées : lorsqu’il y a une différence d’électronegativité importante entre les 2 atomes. Les électrons sont plus souvent sur l’un des atomes, le plus électronégatif. Si la différence d’électronégativité est importante (>0,5).
table d'electronegativité des elements
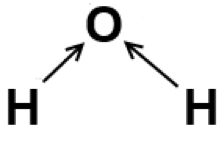
Les électrons sont donc les plus souvent sur O. Cela génère une polarisation des liaisons:
deplacement des electrons vers O
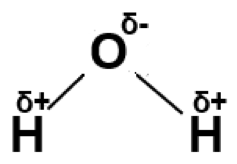
charges partielles sur O et H
