De l'échelle macroscopique à l'échelle moléculaire
Les états de la matière
Toute matière existe sous l’un des 3 états : Solide, Liquide, ou gaz(a). On donne ici une représentation des particules constituant la matière à chacun de ces états. La dimension typique de ces particules est 10-10 à 10-11m. Il peut s’agir d’atomes ou de molécules.

(a) Il existe toutefois une exception à ces 3 états de la matière : il s’agit des substances colloïdales, que l’on trouve souvent en alimentation (gels, aérosols...) ; ce sont des états où la matière est très divisée lorsqu’on l’observe à une échelle moyenne.
Un corps est caractérisé par sa température de fusion(Tf) et sa température d’ébullition (Te)
La température T du corps détermine son état :
- Solide: T<Tf : matière où les atomes occupent des positions fixes (avec vibrations)
- Liquide: Tf<T<Te : matière où les espèces chimiques sont faiblement liées entre elles. L'agitation thermique fait diffuser ces molécules.
- Gaz : T>Te: matière où les espèces chimiques ne sont plus du tout liées entre elles. L'agitation thermique domine.
Exemple : L’éthanol a pour températures de changement d’état : Tf = -114°C et Te = 78°C.
Quelle est son état à température ambiante ?
Réponse : liquide car Tf<T<Te
Masse volumique
Une autre caractéristique d’un corps est sa masse volumique µ :
Formule :
μ=mV
La masse m peut être exprimée en g ou ses multiples (kg, mg…). Le volume peut être exprimé en L (ou multiples comme cL, mL), ou bien m3 (ou multiples).
Exemple d’utilisation de la loi :
Calculer la masse m d’heptane dans un volume de 50cm-3, sachant que sa masse volumique est µ = 0,68 g.cm-3
Réponse :
m=μ×V=0,68×50=34g
Cohésion de la matière
les molécules peuvent être plus ou moins rapprochées entre elles en phase liquide et solide. Cela a une influence sur la masse volumique. Ces molécules sont en interactions par des forces d’attraction plus ou moins fortes. La nature chimique des molécules peut expliquer la force de ces liaisons, et donc la cohésion des substances, leur température de changement d’état, ainsi que leur masse volumique:
Plus la cohésion est forte, plus les molécules ont tendance à se rapprocher. Cala a pour effet d'expliquer pourquoi 2 substances sont miscibles (forte cohésion entre elles). Mais aussi pourquoi la température de vaporisation est plus élevée pour l'eau que pour de nombreux autres liquides.
On a pu voir que les solides sont en général plus denses que les liquides. Ce n’est pas le cas pour l’eau, dont la phase liquide est la plus dense, et c’est pour cela que la glace flotte sur l’eau. C’est encore à cause de la très forte cohésion de l’eau liquide. Plus forte encore que dans la phase solide.
A l’echelle moléculaire, enfin, on peut observer qu’une solution aqueuse est un mélange d’espèces chimiques : les espèces majoritaires, qui constituent le solvant, et les espèces minoritaires, qui constituent le soluté. Ce sont les forces de cohésion dans la matière qui font qu'un solvant donné va dissoudre et solubiliser un soluté.
*Question :* Le Pentane a pour température d'ebullition : T1 = 35°C. L'Hexane a pour température d'ébullition T2 = 69°C. Lequel des deux liquides, Pentane ou Hexane présente la plus forte cohésion entre ses molécules ? *Réponse : l'Hexane*Solutions, solvant, soluté
Définition de solvant
il s’agit d’une espèce chimique le plus souvent liquide qui va accueillir en elle une autre espèce chimique (ce sera le soluté) pour former un mélange homogène [1]. De plus l’espèce chimique qui compose le solvant reste majoritaire devant l’espèce chimique introduite.Définition du soluté
: Il s’agit d’une espèce chimique qui est mélangée à une autre (le solvant). Le soluté est dissout dans le solvant. Le soluté peut être un liquide mais aussi un solide ou encore un gaz ! Définition de la solution :
Le soluté peut être à l’état solide, liquide ou gazeux et il se dissout dans le solvant. La solution obtenue (mélange homogène du soluté et du solvant) peut être solide ou liquide (en pratique on ne parle pas de solution pour un mélange homogène de gaz).
Des exemples :
- Un verre de grenadine : Soluté = sirop (liquide) et Solvant = eau (liquide)
- Un verre de soda : Soluté = dioxyde de carbone CO2 (gaz) et Solvant = eau (liquide)
- Un verre d’eau sucrée (ou salée) : Soluté = sucre en poudre (solide) et Solvant = eau (liquide)
Définition: La dissolution
C'est le terme qui désigne la réalisation du mélange entre l’espèce chimique du soluté et celle du solvant.L’espèce chimique du soluté peut-être une espèce moléculaire ou une espèce ionique.
Définition de la solubilité
La solubilité d'un composé, c'est une quantité maximale (g ou mole) de soluté dissous dans 1 litre de solution saturée selon des conditions précises de température, de nature du solvant et du soluté. Ainsi, on pourra remplacer les expressions courantes "ce composé est soluble, très soluble ou insoluble" en chimie par la valeur de la solubilité.La solubilité s'exprime donc en mol.L-1 ou en g.L-1, comme la concentration. Il s'agit d'ailleurs d'un concentration : C'est la concentration à saturation d'un soluté donné.
Par convention, un composé est dit soluble si sa solubilité est supérieure à 0,1 mole par litre de solution
Un composé sera dit "peu soluble" si sa solubilité est inférieure à 0,1 mole par litre de solution. Le terme "insoluble" sera utilisé pour des composés très peu solubles.
Extraction par solvant
La matière l'échelle microscopique
Pour prévoir les propriétés de la matière à l'échelle macroscopique, il faudra explorer celle ci à l'échelle de l'atome et de ses électrons. Ce sont justement ces électrons qui sont responsables de la stabilité des atomes et des ions, et de leur association en molécules ou en édifice ionique.
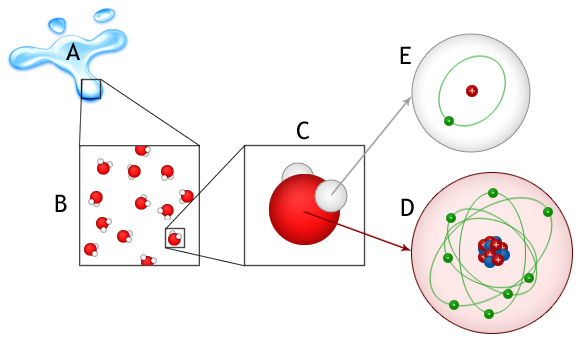
L’eau est une substance (A) constituée de molécules d’eau (B) constituées elles mêmes d’atomes (C ) d’hydrogène (E) et d’oxygène (D).
Formule des molécules
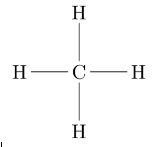
Une molécule est un édifice neutre constituée d’atomes liés entre eux par des liaisons covalentes. La formule de la molécule de méthane s’écrit CH4
Cette écriture signifie qu’elle possède un atome de carbone et 4 atomes d’hydrogène, liés entre eux comme sur la formule développée suivante :
L’atome
 une représentation de l’atome
une représentation de l’atome
Constitution de l’atome
- Un atome est constitué d’un noyau et d’un cortège électronique
- Le rayon de l'atome est voisin de 10 000 fois celui du noyau, ce qui signifie que son noyau est minuscule par rapport aux dimensions de l'atome.
Valeurs :
|
Nom |
Diamètre (en m) |
Charge |
Masse |
|
Proton |
10-15 |
+ e |
mp = 1,67.10 -27kg |
|
Neutron |
10-15 |
0 |
mn = 1,67.10 -27kg |
|
Electron |
10-15 |
- e |
me- = 9,1.10 -31kg |
Noyau de l’atome :
Masse:
Pour faciliter la description du noyau d'un atome, on utilise deux nombres A et Z, qui sont respectivement les *nombres de masse* **A**, et le *numéro atomique* **Z**. Ces nombres ont un rapport avec les particules du noyau, les nucléons (protons et neutrons) :- Le noyau d’un atome est constitué de nucléons de 2 sortes : les protons et les neutrons
- Le nombre total de nucléons est appelé nombre de masse et se note A
- Le nombre de protons du noyau est égal à son numéro atomique et se note Z
|
|
Diamètre (en m) |
Charge |
Masse |
|
Noyau |
10-14 |
+ Z.e |
A . mnucléon |
|
Atome |
10-10 |
0 |
= mnoyau |
La masse de l’atome étant concentrée dans son noyau, pour calculer la masse d’un atome, on fait :
m=A×mnucléon
Application
Calculer la valeur de la masse de l’atome d’Helium He, de nombre de masse A = 4.Réponse : m=A×mnucléon=4×1,67.10−27=6,7.10−27kg
Charge électrique
Le noyau est toujours chargé d'électricité de nature *positive*. C'est grâce à l'une de ses particules, le *proton*. Chaque proton porte un *nombre de charge* +1. *Ne pas confondre* : *nombre de charges*, et *charge électrique*. Le **nombre de charges** du noyau est égal à son nombre de protons : 1 proton => nombre de charge = +1 ; 2 protons => nombre de charges +2 ; etc... La **charge** du noyau dépend du *nombre de charges*. Elle se note **q**. Elle peut se déduire du nombre de charges. Il s'agit d'une grandeur électrique mesurable, en Coulombs. C'est la grandeur qui permet de mesurer la quantité d'électricité contenue dans une pile ou une batterie.- La charge électrique portée par le proton est notée e et appelée: charge élémentaire.
e = 1,6.10-19 C (coulomb)
On a vu que le nombre de charge du proton est noté +1
le noyau de l’atome a donc une charge électrique notée q, égale à :
q=Z×e
- Le neutron est une particule neutre
Electrons :
- Un électron a une charge négative opposée à celle d’un proton et notée -e.
-e = -1,6.10-19 C
Son nombre de charge est noté -1
- Un atome possède autant d’électrons dans son cortège électronique que de protons dans son noyau (donc autant que son numéro atomique Z)
- Des électrons peuvent quitter le cortège électronique, d'autres peuvent venir. L'énergie mise en jeu est assez faible (réaction chimique, friction mécanique)
- Lorsque l'édifice atomique n'est plus neutre, on dit qu'il s'agit d'un **ion**.
Neutralité électrique de l'atome
Un atome est une particule électriquement neutre, ce qui signifie que sa charge électrique globale est nulle: q=0Un ion
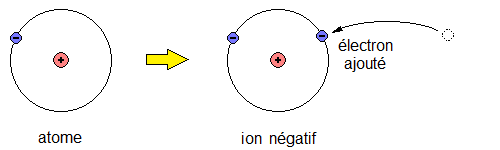
La charge électrique q d'un ion, en Coulombs, se calcule alors d'après la relation :
q=(Z−N)×e
Application 1 :
Déterminer le nombre de charge de l'ion aluminium, si son numéro atomique est Z = 13, et qu'il possède 10 électrons.Réponse : Z - N = 13 - 10 = +3, on note alors cet ion : Al3+
Application 2 :
calculer la charge électrique de l’ion Al3+, dont le numéro atomique est Z = 13.Réponse : L’ion de nombre de charge +3 possède 3 électrons de MOINS que l’atome Al.
Sa charge électrique, en Coulombs est donc égale à :
q=3×−e=3×1,6.10−19=4,8.10−19C
