Approche experimentale
Il y a celles dont dont la quantité diminue : LES REACTIFS
Et celles dont la quantité augmente : LES PRODUITS
On écrit alors une équation chimique pour rendre compte du type d’espèces et des quantités qui sont mises en jeu.
On peut alors faire un bilan de ces espèces chimiques. Cela servira à modéliser cette transformation chimique.
modélisation
réactifs et produits
On a vu dans le chapitre précédent que l’on appelle REACTIFS les espèces dont la quantité diminue et PRODUITS, ceux dont la quantité augmente. Avec l’experience de la combustion du méthane, on peut proposer :
Le diazote N2, dont la quantité ne semble pas varier, ne sera ni un produit, ni un reactif. On ne le mentionnera pas dans l’équation de réaction (voir plus bas).
équation de transformation
Cette équation rend bien compte de la nature (réactif ou produit) de chaque espèce. Mais elle ne rend pas compte des lois de conservation. Il faudra équilibrer les espèces à l’aide de coefficients.
Lois de conservation
En 1777, Antoine Lavoisier «Rien ne se perd, rien ne se crée, tout se transforme.»1
La conservation de la masse (ou de Lavoisier) est une loi fondamentale de la chimie et de la physique. Elle indique non seulement qu’au cours de toute expérience, y compris si elle implique une transformation chimique, la masse se conserve, mais aussi que le nombre d’éléments de chaque espèce chimique se conserve.
Lavoisier expliquant le résultat de ses expériences sur l’air à sa femme. Huile sur toile d’Ernest Board (image wikipedia)

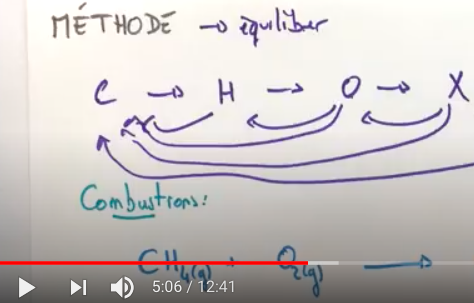
Méthode pour équilibrer une équation
Equilibrer = ajuster les coefficients stoechiométriques.
On pourra consulter la video suivante de la chaine mathrix sur youtube :
lancer la video
Question b : Equilibrer l’équation chimique de combustion de l’éthane C2H6
Remarque : les coefficients stoechiometriques peuvent être décimaux, et donc, comporter une virgule.
Question c : Equilibrer l’équation de précipitation du chlorure de cuivre CuCl2
Remarque : dans ce dernier exemple, des espèces chimiques en solution aqueuse, des ions (d’où leur symbole aq), reagissent ensemble pour former un nouveau composé solide (d’où le s).
Question d : Vérifier que les charges électriques sont bien conservées après avoir équilibré l’équation : le bilan des charges + et - doit être le même côté réactif et côté produit.
Réactions acido-basiques
Définitions
- Un acide est une espèce chimique susceptible de céder un ion H+
- Une base est une espèce susceptible de capter un ion H+
- Un couple acide/base est constitué de 2 espèces A et B liées par l’équilibre chimique :
A ⇄ B + H+
C’est l’équation de transformation du couple.
Exemples :
- H2O + H+ ⇄ H3O+ couple : H3O+/H2O
- H2O ⇄ HO- + H+ couple : H2O/HO-
- CH3COOH ⇄ CH3COO- + H+ couple : CH3COOH / CH3COO-
Réaction acido-basique = échange d’ions H+
Souvent, lorsqu’un acide est mis en contact avec une base, il se produit une réaction acide-base telle qu’il y a un échange d’ion H+ entre l’acide (donneur) et la base (accepteur) :
acide1 + base2 ⟶ base1 + acide2
Cette réaction est d’autant plus quantitative que l’acide du couple 1 est fort, et que la base du couple 2 est forte.
Définition: Une réaction acido-basique est donc une réaction chimique au cours de laquelle des espèces chimiques échangent des ions H+
Exemple: De l’acide ammoniacal (solution contenant l’ion ammonium NH4+) réagit avec une solution basique, contenant des ions hydroxydes. Ecrire l’equation de reaction.
Pour déterminer l’équation de cette réaction acido-basique, on commence par écrire les 2 couples acide/base de ces 2 espèces, puis on choisit les espèces à écrire en suivant le symbole Gamma:
S'aider du symbole Gamma pour écrire l'équation
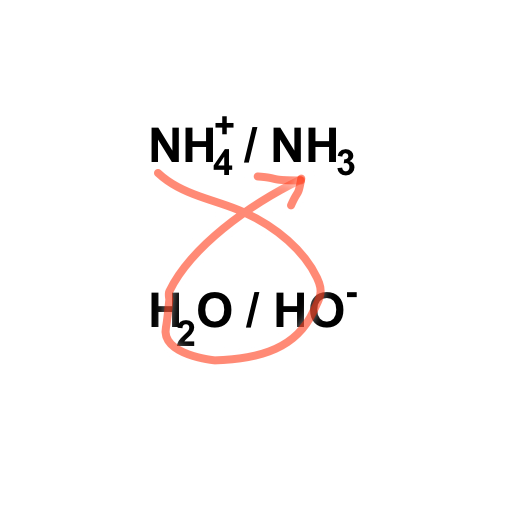
$$NH_4^+ + HO^- \rightarrow H_2O + NH_3 $$
Transformations avec un diacide
Un diacide est une espèce qui manifeste une acidité double.
C’est par exemple, l’acide sulfurique. Son couple est H2SO4/ SO42- et l’équation de sa transformation:
$$H_2SO_4 = SO_4^{2-} + 2 H^+$$
Il existe aussi des triacides. Dans ces cas, il peut être necessaire d’écrire les demi-equations de transformation des deux couples avant d’écrire celle acido-basique. L’échange d’ions H+ doit toujours concerner le même nombre d’ions échangés: l’acide doit céder autant d’ions que la base va en capter.
Ainsi, si l’acide sulfurique doit réagir avec l’ion hydroxyde, (couple H2O/HO-) dont l’équation de transformation est:
$$HO^- + H^+ = H_2O$$
Alors l’équation de reaction acido-basique entre l’acide sulfurique (qui donne 2H+ et l’ion hydroxyde (qui en capte un seul) sera alors:
$$H_2SO_4 + 2HO^- \rightarrow SO_4^{2-} + 2 H_2O$$
Il apparait un coefficient 2 devant HO-. Vous pourrez alors vérifier que cette équation respecte bien les lois de conservation énoncées plus haut.
Compléments et notes
- Exercez vous à l’aide de flash cards
-
La citation exacte est en fait :« … car rien ne se crée, ni dans les opérations de l’art, ni dans celles de la nature, et l’on peut poser en principe que, dans toute opération, il y a une égale quantité de matière avant et après l’opération ; que la qualité et la quantité des principes est la même, et qu’il n’y a que des changements, des modifications. » Lavoisier, Traité élémentaire de chimie (1789), p. 140 ↩︎
