La quantité de matière en chimie
Définition de la mole
La mole1, est une unité de mesure des quantités de matière du Système International.
Le nombre d’entités (atomes, molécules, ions, électrons, etc.) contenues dans une mole est connue sous le nom de constante d’Avogadro, noté NA : NA=6,02214129×1023mol−1
Cette constante, d’importance fondamentale en chimie, permet de faire le lien entre la matière à l’état microscopique et à l’état macroscopique.
Des unités de quantité de matière
quelques repères
Ce concept d'unité de quantité de matière vous est déjà familier : il arrive que l’on rassemble les objets par paquets de dimension fixe :
- La paire contient ainsi : 2 objets
- La douzaine contient : 12 objets
- …
- La mole contient : 6,02.1023 objets
dénombrer les objets par paquets
n paires
Vous avez n = 20 paires de chaussures dans votre placard. Cela signifie que vous possédez :
N=n×2
Soit N = 40 chaussures. Cette relation pourrait aussi s’exprimer sous la forme :
n=N2
n douzaines
Une bouriche de N = 66 huitres contient n douzaines, que l’on peut calculer avec la relation :
n=N12
n=6612
n=5,5douzaines
n moles
Un échantillon de N = 1021 atomes contient un nombre n de mol, tel que :
n=NNA
n=10216,02×1023
n=1,66.10−3mol
Dénombrer avec la masse molaire
masse molaire
C’est la masse d’une mole d’objets. On la note M (majuscule), et son unité est en g.mol-1
On distingue ainsi:
la masse molaire atomique
La masse molaire atomique est indiquée dans le tableau périodique des éléments voir en bas de page
- La masse d’une mole d’atomes d’oxygène vaut M(0) = 16 g. On note: M(O) = 16 g.mol-1
la masse molaire moléculaire
La masse d’une mole de molécule se calcule à partir de ses atomes constituants:
- La masse d’une mole de dioxygène vaut :
M(O2)=2×M(O)=2×16=32g
On note: M(O2) = 32 g.mol-1
méthode
si 1 mole d’objet pèse M : alors n mol d’objet pèse m.
On peut représenter ces grandeurs de la manière suivante :
| 1 | M |
|---|---|
| n | m |
On a alors la relation :
n=mM
application
On a vu que la masse molaire de O2 vaut M = 32 g. Si on dispose d’un échantillon gazeux de masse m = 1,8 g de O2, alors on peut évaluer le nombre de moles qu’il contient :
n=mM
n=1,832
n=5,2.10−2mol
tableau périodique réduit des éléments
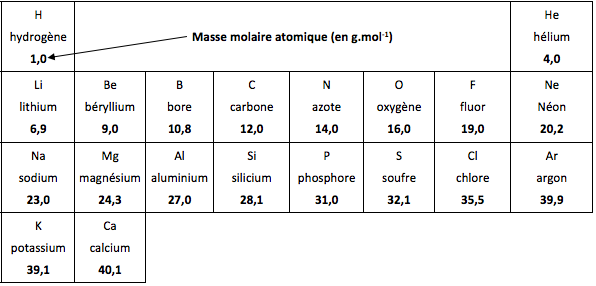
masses molaires atomiques
La concentration molaire
Definition
La concentration molaire d’une espèce X en solution, notée [X], mesure la quantité de matière (le nombre de mol) de l’espèce X qu’il y aurait dans 1L de solution. Cette concentration s’exprime en mol.L-1.
Loi de concentration molaire
Pour un volume V de solution, contenant n mol de soluté X:
[X]=nV
Applications
Proportionnalité
Comme pour le calcul de quantité de matière, on peut résoudre un problème de concentration par proportionnalité:
Enoncé: Soit une solution S de volume V = 0,1L, contenant 0,05 mol d’ions Cl-. Calculons la concentration molaire en ions Cl-
Résolution:
On fait la corrspondance suivante:
| n(mol) | volume(L) |
|---|---|
| 0,05 | 0,1 |
| n | 1 |
On a donc:
n=0,050,1
n=0,5mol
Donc la concentration molaire est : [Cl−]=0,5mol.L−1
Utiliser la loi de concentration
Pour le même énoncé, on pose:
[Cl−]=nV
[Cl−]=0,050,1
Soit:
[Cl−]=0,5mol.L−1
L’essentiel
$$n = \tfrac{m(ech)}{M(atome)}$$
</li>
<li>Concentration molaire<br>
[X] mesure la quantité de matière (le nombre de mol) de l'espèce X qu'il y aurait dans 1L de solution.<br>
$$[X] = \tfrac{n}{V}$$
<ul>
<li>n : nombre de mol de X</li>
<li>V : volume de solution</li>
</ul>
</li>
<li>Tableau résumé<br>
<table>
<tr><td>grandeur</td><td>unité</td></tr>
<tr><td>n</td><td>mol</td></tr>
<tr><td>M</td><td>g/mol</td></tr>
<tr><td>m</td><td>g</td></tr>
<tr><td>V</td><td>L</td></tr>
<tr><td>[X]</td><td>mol/L</td></tr>
</table>
</li>
-
La mole est la quantité de matière d’un système contenant autant d’entités élémentaires qu’il y a d’atomes dans 0,012 kilogrammes de carbone 12 ↩︎
