Molécules et forces intermoléculaires
**Postulat:** Deux substances sont miscibles si les molécules qui les constituent forment des forces d'attraction intermoléculaires. Des molécules peuvent s'attirer si elles forment des liaisons du type: * dipôle-dipôle * liaison hydrogène * ion-dipôle ou bien, si les molécules sont toutes apolaires. Il faut donc rechercher dans ces molécules, la présence eventuelle de charges partielles. Ces charges sont la conséquence de la polarisation de certaines liaisons.Liaison polarisée
On observe la différence d'ectronegativité des atomes engagés dans les liaisons. Trois cas sont à considérer : - Liaison apolaire ou très faiblement polaire : Lorsque la différence d'electronegativité est nulle ou faible (<0,6). le doublet d’électrons est alors équitablement réparti => Pas de charges partielles.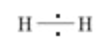
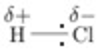
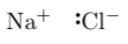
Molécule polaire
Une molécule polaire comprend des liaisons polarisées. * Si les molécules de 2 substances sont toutes les 2 polaires, alors ces 2 substances sont solubles. Elles forment entre elles des liaisons intermoleculaires, de type dipole-dipole. * Une substance polaire et une substance non polaire ne sont PAS solubles. Elles ne forment aucune liaisons intermoleculaires.Liaison hydrogène
La liaison hydrogène est une force intermoléculaire impliquant un atome d'hydrogène et un atome d'oxygène ou d'azote, non liés par une liaison covalente (présents sur 2 molécules ou 2 parties d’une même molécule). Pour faire simple, une molécule contenant de nombreux atomes O ou N, bien repartis sur la molécule, est susceptible de former des liaisons hydrogènes. * Si les molécules de 2 substances peuvent former des liaisons hydrogènes entre elles, c’est à dire qu’elles possèdent toutes les 2 des atomes d’hydrogène ET d’oxygène (ou d’azote), alors ces 2 substances sont solubles.Molécule apolaire
* Si les molécules de 2 substances sont toutes les 2 apolaires, alors ces 2 substances sont solubles. Elles forment entre elles des forces intermoléculaires.Interaction avec un ion
Les ions sont solubles dans un solvant POLAIRE. Il se forme alors, entre le solvant et l’ion des forces de type ion-dipole. L'action de solubiliser un ion s'appelle la solvatation. L'eau est capable de solvater indifféremment des anions et des cations, grâce aux forces de nature electrostatique, de type ion-dipole, que l'eau peut faire avec ces ions: Solvatation d’un anion :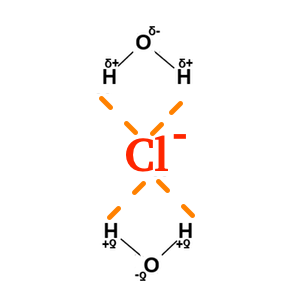
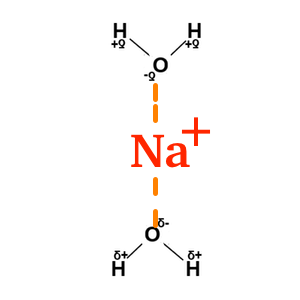
Solubilité
Soluble ou non soluble
On désigne souvent pas soluble ou insoluble la (non) capacité d’un soluté à se dissoudre dans un solvant. Mais pour être précis, il vaudrait mieux parler de la quantité qui peut être dissoute dans le solvant.Definiton de la solubilité
C’est la quantité maximale d’un soluté donné que l’on peut dissoudre dans un solvant. Désignée aussi par « s » exprimée en g/L ou en mol/L : concentration de la solution à saturation Exemple : s(glucose/eau) = 900g/L Vue que la valeur est très élevée, on peut considérer que le glucose est TRES soluble dans l’eau. s(rouge de methyle/eau) = 0,1g/L Cette valeur très basse suggère que le rouge de methyle est quasi insoluble dans l’eau.Extraction
Les extractions sont parmi les méthodes les plus utilisées en analyse pour séparer les mélanges. Elles reposent sur la différence de solubilité d'un soluté entre deux phases non-miscibles entre elles. L'idée est de transférer un soluté d'une phase liquide à une autre phase liquide non-miscible à la première.
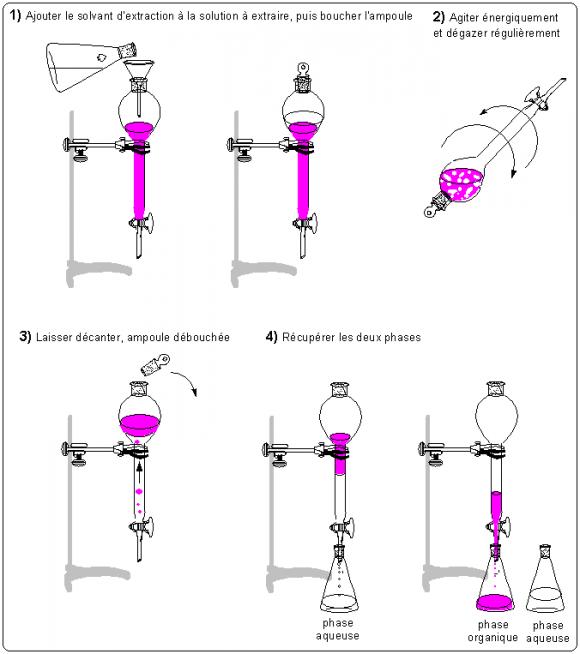
Exemple : l'extraction du diiode d'une solution aqueuse par le cyclohexane
On donne le tableau de solubilité/miscibilité des espèces :
|
Solubilité |
Diiode |
Eau |
Cyclohexane |
|
Dans l’eau |
Faible |
|
Non miscible |
|
Dans le cyclohexane |
Grande |
Non miscible |
|
On choisit d'extraire le diiode dissout dans une solution aqueuse par du cyclohexane. D'après le tableau des solubilités, celui ci est plus soluble dans le cyclohexane que dans l'eau. On verse alors la solution de diiode dans l'ampoule à décanter, suivie de cyclohexane. Les 2 liquides sont non miscibles. Le cyclohexane occupe la phase supérieure, sa densité étant plus faible que l'eau :

